伴随着衰老或异常红细胞的清除,游离的血红素同时被分解代谢。胆红素是血红素分解产生的一种高度疏水性分子,在人体内的积累常常导致各种疾病,包括黄疸和严重肝脏疾病。在肝细胞中,胆红素经过与葡萄糖醛酸缀合,生成亲水性的缀合胆红素,最终被转运蛋白ABCC2清除。人类ABCC2属于ABC转运蛋白超家族C亚家族,同时是一种多药耐药蛋白(MRP),定位于肝细胞的胆小管膜上,利用ATP水解产生的能量将葡萄糖醛酸胆红素从肝细胞转运到胆汁中进行代谢。先天ABCC2的功能缺陷导致缀合胆红素在肝细胞中积累,诱发遗传性缀合型高胆红素血症,又称为杜宾-约翰逊综合征(Dubin-Johnson syndrome)。除此之外,作为一种多药耐药蛋白,ABCC2还可以外排谷胱甘肽化的多种抗癌药物,导致耐药性。然而,ABCC2的三维结构及其转运广谱底物的分子机制未知。
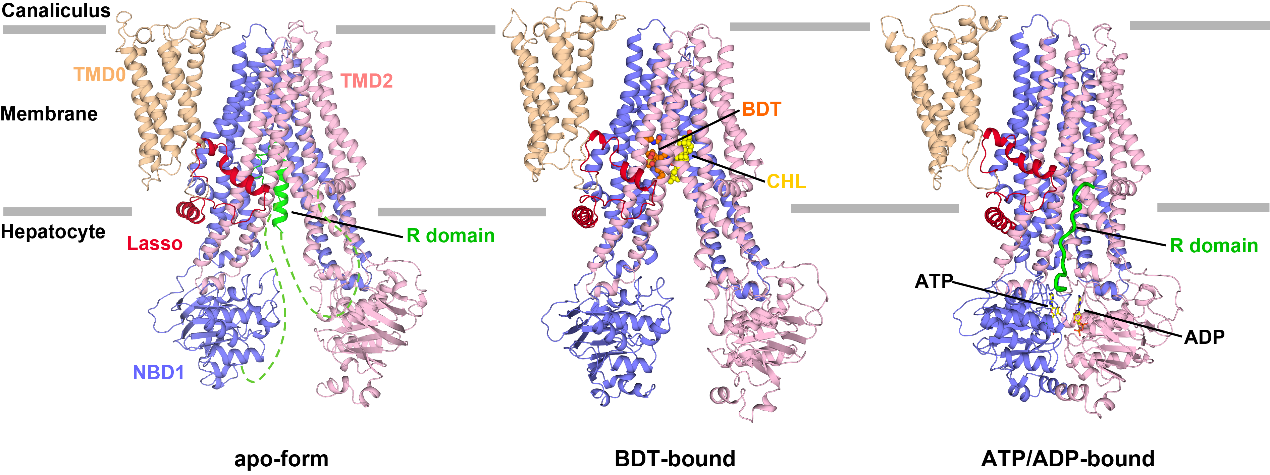
图 1. ABCC2的三维结构
近日,陈宇星教授和周丛照教授课题组利用单颗粒冷冻电镜技术解析了人类合胆红素转运蛋白ABCC2的无配基(apo-form)以及分别结合底物类似物和ATP/ADP的三种状态的三维结构,整体分辨率分别为3.6、3.3和3.6 Å(图1)。基于蛋白质结构以及生化分析,作者提出了一种独特的调控结构域(R-domain)精细调控ABCC2底物识别的转运的分子机制,相关研究成果以“Transport mechanism of human bilirubin transporter ABCC2 tuned by the inter-module regulatory domain”为题于2024年2月5日在线发表在《Nature Communications》上。
结构分析表明,apo-form ABCC2结构呈现向细胞质基质开口(inward-facing)的构象,两个核苷酸结合结构域(NBD)彼此分开。连接NBD1与跨膜结构域TMD2的调控结构域(R-domain)折叠成发夹结构,并结合到底物转运口袋中,阻止底物的结合,将蛋白质锁定在非活性构象。一旦结合生理底物类似物--二牛磺酸胆红素(BDT),ABCC2仍然处于inward-facing构象,但是R结构域从底物结合口袋中释放。基于结构和生化分析结果,我们推测R结构域作为竞争性亲和力过滤器,阻止某些低亲和力底物的结合,以确保高亲和力缀合胆红素优先向外转运。ATP结合进一步促进ABCC2的构象转变,NBD二聚化后ATP分子被水解,ABCC2转变为封闭构象,底物释放到胆小管中。在这种构象中,R结构域与跨膜螺旋TM14和TM15结合,使ABCC2稳定在这种ATP/ADP结合的活性转换中间态,确保底物的有效转运(图2)。基于上述研究,可以清晰解释R1150H突变体因为减弱了R结构域与TMD2的结合,使得ABCC2的转运活性受损,因此导致临床疾病。该研究不仅描绘了ABCC2在R结构域精细调控下的分子模型和底物转运机制,还为ABCC2功能异常导致的杜宾-约翰逊综合征的提供了分子病理学依据。
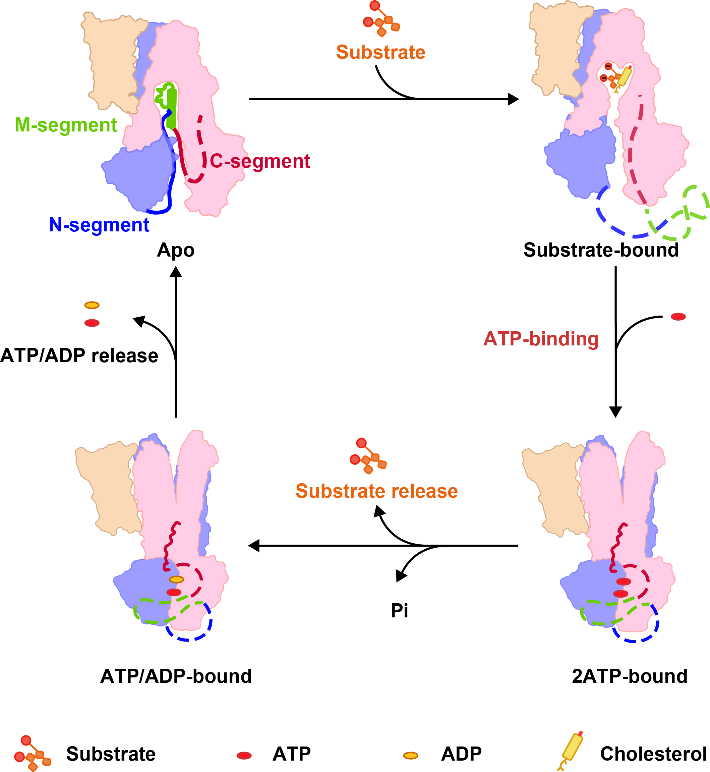
图2. R结构域调控ABCC2底物转运的机制模型
中国科学技术大学陈宇星教授、周丛照教授和侯文韬副教授为该论文的共同通讯作者,博士生毛耀许和博士后陈志鹏为该论文的第一作者。冷冻电镜数据收集工作在中国科学技术大学集成影像中心完成。该研究得到了科技部、国家自然科学基金委和中国科学院的资助。
原文链接:[backcolor=transparent !important]https://rdcu.be/dxQOp
